Príncipe Louis-Victor Pierre Raymond de Broglie, más conocido como Louis de Broglie, presentó, en 1924, su tesis doctoral “Investigaciones sobre la teoría cuántica”, en la que aseveraba la dualidad onda-partícula de los electrones, sentando las bases de la mecánica ondulatoria. Asimismo, publicó importantes hallazgos teóricos sobre la naturaleza onda-corpúsculo de la materia a escala atómica.
Posteriormente, en 1927, los enunciados de Broglie fueron demostrados experimentalmente por los científicos Clinton Davisson y Lester Germer.
La teoría de onda de los electrones de Broglie se fundamenta en la propuesta de Einstein sobre las propiedades ondulatorias de la luz en longitudes de onda cortas. De Broglie anunció la posibilidad de que la materia tuviese un comportamiento similar al de la luz, y sugirió propiedades similares en partículas subatómicas como los electrones.
De Broglie explicó el movimiento de los electrones alrededor del núcleo atómico teniendo en cuenta que cargas eléctricas y órbitas restringen la amplitud, longitud y frecuencia de la onda descrita por los electrones.
La teoría de onda de los electrones de Broglie justificó el éxito del modelo atómico de Bohr para explicar el comportamiento del electrón único del átomo de hidrógeno.
Análogamente, también dio luces sobre por qué este modelo no se ajustó a sistemas más complejos, es decir, átomos con más de un electrón.
Experimento de Davisson y Germer
Los destacados físicos estadounidenses Clinton J. Davisson y Lester Germer confirmaron de forma experimental la teoría de la mecánica ondulatoria de De Broglie en 1927.
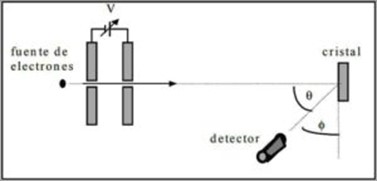
Realizaron pruebas de dispersión de un haz de electrones a través de un cristal de níquel y observaron el fenómeno de difracción a través del medio metálico. Para ello:
- Colocaron un montaje con haz de electrones que tenía una energía inicial conocida.
- Instalaron una fuente de voltaje para acelerar el movimiento de electrones incitando una diferencia de potencial.
- Dirigieron el flujo del haz de electrones hacia un cristal metálico; en este caso, níquel.
- Midieron el número de electrones que impactó en el cristal de níquel.
Al finalizar el experimento, Davisson y Germer detectaron que los electrones se dispersaban en diferentes direcciones.
Al repetir el experimento empleando cristales metálicos con distintas orientaciones, los científicos observaron lo siguiente:
La dispersión del haz de electrones a través del cristal metálico era comparable con el fenómeno de interferencia y difracción de los rayos luminosos.
La reflexión de los electrones sobre el cristal de impacto describía la trayectoria que, teóricamente, debía describir según la teoría de ondas de electrones de Broglie.
En síntesis, el experimento de Davisson y Germer comprobó experimentalmente la naturaleza dual onda-partícula de los electrones.
Limitaciones
- El modelo atómico de Broglie no predice la ubicación exacta del electrón sobre la órbita en la cual se desplaza.
- En este modelo, los electrones se perciben como ondas que se movilizan en toda la órbita sin una ubicación específica, con lo cual se introduce el concepto de orbital electrónico.
- Además, el modelo atómico de Broglie, análogo al modelo de Schrödinger, no considera la rotación de los electrones sobre su mismo eje (spin).
- Al obviar el momento angular intrínseco de los electrones, se están dejando de lado las variaciones espaciales de estas partículas subatómicas.
- En el mismo orden de ideas, este modelo tampoco toma en cuenta los cambios en el comportamiento de los electrones rápidos como consecuencia de los efectos relativistas.