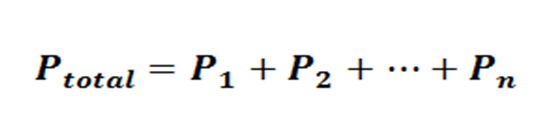6 de septiembre de 1766, Cumberland (Reino Unido) – 27 de julio de 1844, Mánchester (Reino Unido)
Nació en el seno de una familia cuáquera y fue enviado a una escuela donde aprendió matemáticas y destacó lo suficiente como para que, a los 12 años, comenzase a dar clase a otros niños tanto en casa como en el templo cuáquero. Los ingresos familiares eran modestos por lo que se dedicó a trabajos agrícolas hasta que en 1871 se asoció con uno de sus cinco hermanos, Jonathan, que ayudaba a uno de sus primos a llevar una escuela cuáquera en Kendal.
Es en esta época cuando Dalton se ve influenciado por un conocido meteorólogo y fabricante de instrumental cuáquero llamado Elihu Robinson que despertó su interés por las matemáticas y la meteorología y que le llevó a publicar varios libros.
En 1790, Dalton consideraba la posibilidad de estudiar derecho o medicina, pero su familia no le apoyó por lo que permaneció en Kendal hasta que, en 1793, se trasladó a Mánchester. Gracias a las enseñanzas adquiridas por el filósofo y erudito John Gough, Dalton fue nombrado profesor de matemáticas y filosofía natural en la “Nueva Escuela” de Mánchester, una academia de disidentes religiosos. Conservó el puesto hasta que, en 1800, una crisis financiera de la academia le obligó a dejar su puesto y comenzar una carrera como profesor particular.
Daltonismo
En 1794, Dalton fue elegido miembro de la Sociedad Filosófica y Literaria de Mánchester, más conocida como “Lit&Phil”, en la que presentó su primer trabajo, “Hechos extraordinarios relacionados con la visión de los colores”, que postulaba que las deficiencias en la percepción del color se deben a anomalías del humor vítreo. Era la primera vez en la que no solo se describía el hecho de la falta de percepción del color en algunas personas, sino que también se daba una explicación al fenómeno. Aunque su teoría fue desacreditada estando él mismo en vida, la investigación profunda y metódica que realizó sobre su propio problema visual causó una impresión tal que su nombre se convirtió en el término común para designar la ceguera al color, el daltonismo.
Dalton descubrió que veía los colores de diferente manera al realizar investigaciones botánicas y dejó instrucciones de que sus ojos fueran conservados, lo que ha permitido que los análisis de ADN, publicados en 1995, demostraran que en realidad padecía un tipo menos común de ceguera al color, la deuteranopia. Sólo era capaz de ver azul, púrpura y amarillo.
Esta ceguera a ciertos colores dificultó en ocasiones su trabajo científico, especialmente en el laboratorio donde confundía los frascos de reactivos, o en aspectos sociales, como cuando fue a conocer al rey Guillermo IV en 1832. Lució una vestimenta académica escarlata, un color nada habitual para un hombre como él y que sorprendió a sus conocidos. La razón era que Dalton la veía de color gris oscuro.
Ley de las Presiones Parciales
Entre 1800 y 1802, siendo Dalton secretario de Lit&Phil, publicó cuatro artículos sobre la constitución de las mezclas de gases; la presión de vapor de agua y otros vapores a diferentes temperaturas, tanto en el vacío como en aire; sobre la evaporación y acerca de la expansión térmica de los gases. Llegó a la conclusión, a partir de las observaciones de la presión de vapor de seis líquidos diferentes, que la variación de la presión de vapor para todos los líquidos es equivalente, para la misma variación de la temperatura, determinados a partir de vapor a cualquier presión.
En 1810, Dalton postuló que: “La presión total de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones que ejercería cada gas si estuviera sólo en el recipiente, sin variar la temperatura”.
Pesos atómicos
En una entrada de su cuaderno de laboratorio fechada el 6 de septiembre de 1803, aparece una tabla de pesos relativos de átomos de seis elementos: hidrógeno, oxígeno, nitrógeno, carbono, azufre y fósforo, que derivan del análisis del agua, amoniaco, dióxido de carbono y otros compuestos de la época.
Afirmaba, por ejemplo, que los átomos del elemento de hidrógeno eran los más livianos que existían y que el peso de un átomo de hidrógeno era la dieciseisava parte del de un átomo de oxígeno, así que asignó al átomo de hidrógeno un peso de uno y al del oxígeno, dieciséis.
Ley de las proporciones múltiples o Ley de Dalton
“Cuando dos o más elementos se combinan para dar más de un compuesto, una masa variable de uno de ellos se une a una masa fija del otro y la primera tiene como relación números canónicos e indistintos”.
Dalton trabajó con el hecho de que existen algunos elementos que pueden relacionarse entre sí en distintas proporciones para formar distintos compuestos. Así, por ejemplo, hay dos óxidos de cobre, el CuO y el Cu2O, que tienen un 79,89 % y un 88,82 % de cobre, respectivamente, y que equivalen a 3,974 gramos de cobre por gramo de oxígeno en el primer caso y 7,945 gramos de cobre por gramo de oxígeno en el segundo. La relación entre ambas cantidades es de 1:2 como se expresa actualmente con las fórmulas de los compuestos derivados de la teoría atómica.
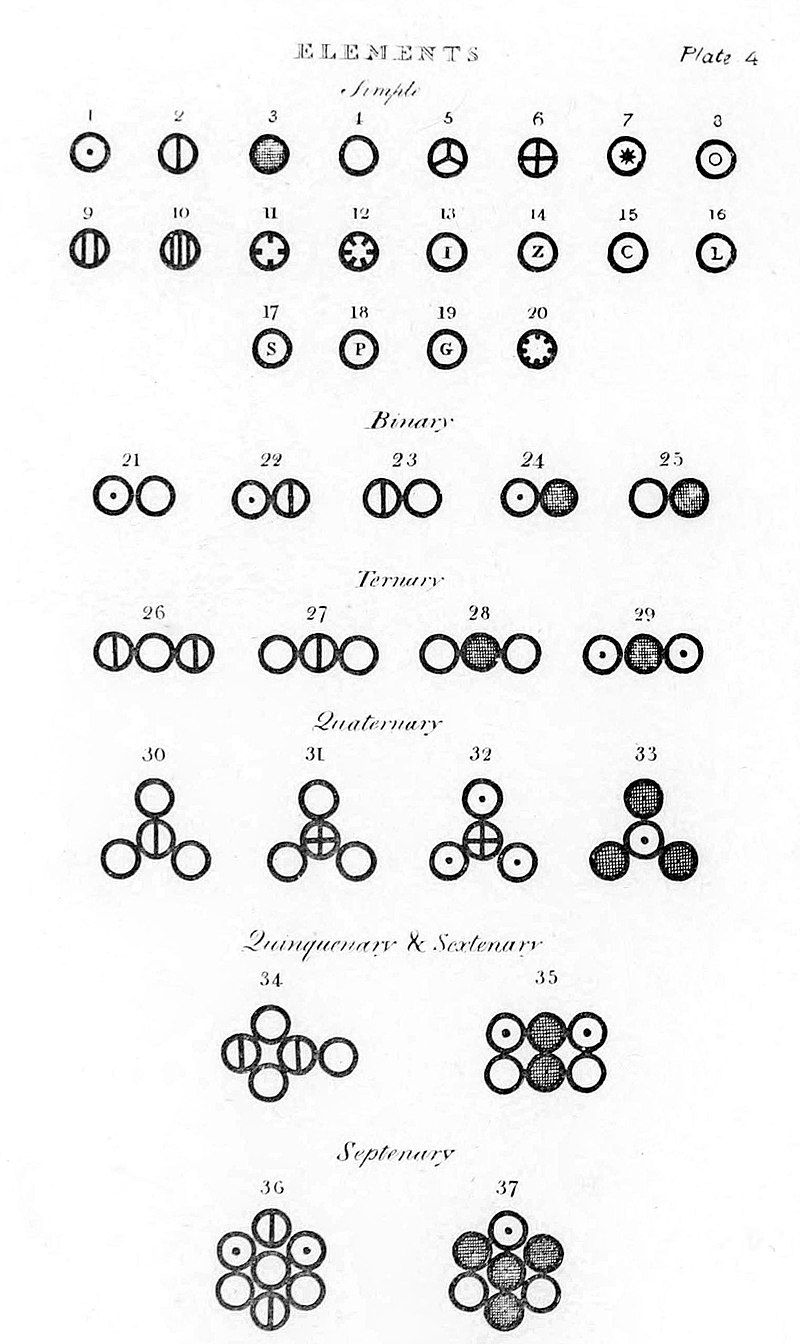
En 1808, en su obra “Un nuevo sistema de filosofía química”, los compuestos fueron enumerados como binarios, ternarios, cuaternarios, etc., en función del número de átomos que el compuesto tenía en su forma más simple, la forma empírica.
En dicha publicación, Dalton utilizó sus propios símbolos para representar visualmente la estructura atómica de los compuestos.
Esta ley fue demostrada por el químico y físico francés Louis Joseph Gay-Lussac.
La teoría atómica
En 1803, presentó un primer sistema de símbolos y abreviaturas de los nombres de los elementos, convirtiéndose en el primer diseñador gráfico atómico de la historia y ampliando la lista de 33 sustancias presentadas por Antoine Lavoisier a 36.
Estos símbolos permitieron convertir el lenguaje químico en un lenguaje universal. El inconveniente era que no contaba con la aprobación de todos los químicos y no establecía unas reglas claras para ampliar el catálogo de símbolos en caso de descubrir nuevos elementos.
Actualmente, se utiliza el sistema creado por el químico sueco Jöns Jacob Berzelius en 1814 y que está basado parcialmente en el que Dalton presentó. Éste simplificó el sistema organizándolo en 47 letras que se correspondían con las iniciales del nombre del elemento en latín, tal y como se estaba haciendo en otras disciplinas, y agregando una segunda letra cuando había necesidad de diferenciar dos elementos cuyo nombre comenzaba con la misma letra inicial.
La propuesta de Berzelius contó con más aceptación entre los químicos porque permitía combinar la escritura de los elementos químicos con texto corriente evitando muchas de las confusiones que generaban los símbolos de Dalton.
Entre 1803 y 1808 propuso lo que sería el primer modelo con bases científicas, aunque él lo denominó “teoría atómica” en el que se postulaba que:
- La materia está constituida a partir de átomos, unidades de materia indivisible que no se pueden ni generar ni destruir.
- Los átomos de un elemento concreto tienen el mismo tamaño, peso y cualidades y los átomos de distintos elementos, poseen distintas características entre sí.
- Los compuestos se forman gracias a la combinación de los átomos de dos o más elementos diferentes.
- Si bien pueden combinarse para formar diferentes compuestos, los átomos en sí permanecen inalterables, no pudiendo ser divididos ni destruidos.
- Un mismo compuesto es producido siempre por una misma proporción en la combinación de los átomos.
- La combinación de diferentes tipos de átomos se lleva a cabo a través de relaciones simples.
- La combinación entre dos elementos concretos pueda dar lugar a compuestos diferentes en función de las proporciones en las que se mezclen.
- En las reacciones químicas es posible crear, disociar o transformar moléculas, siendo estas una reorganización de los átomos que componen cada compuesto.
La teoría atómica de Dalton ha sido una de las más importantes en la ciencia a la hora de describir la estructura de la materia. Sin embargo, desde que se publicó se han producido grandes avances que han demostrado que algunos postulados no son ciertos:
- “El átomo es una unidad básica e indivisible”. Falso. Se ha podido distinguir dentro del átomo diferentes partes formadas por estructuras subatómicas tales como los protones, neutrones y electrones.
- “Todos los átomos de una misma sustancia tienen iguales propiedades”. Falso. Se pueden encontrar átomos de diferente carga eléctrica según el balance entre protones y electrones (lo que se conoce como iones), así como diferentes masas atómicas de un mismo elemento (los isótopos).
- “Los átomos son inmodificables”. Falso. Se ha demostrado que no es así con la llegada de la fisión y fusión nuclear.
A pesar de ello, la teoría de Dalton ha sentado las bases de la química moderna y ha permitido un gran avance en la comprensión de la materia y su comportamiento.